从2016 年日本细胞生物学家大隅良典在阐明细胞自噬的分子机制和生理功能上的开拓性研究获得诺贝尔奖以来,自噬引起了众多科研工作者的广泛关注,成为当前生命科学/基础医学研究的一大热点。
近年来,以细胞自噬为研究对象的高分文章不断涌现,也成为国家自然科学基金资助项目中炙手可热的研究领域。2023年最佳国自然“中标”研究热点中,「自噬」荣登榜首第五,中标率高达364。在pubmed数据库中输入“autophagy”,文章数量为83,890篇,2023年的发文量有9988篇。

近日,来自德国的研究员们在Nature出版集团旗下刊物《Cell Death & Disease》发表了题为“GRB2 is a BECN1 interacting protein that regulates autophagy”的研究论文,确定了GRB2 是一种新的 BECN1 相互作用蛋白,也是自噬和肿瘤生长的潜在新调节因子。

一、研究背景
乳腺癌常被称为“粉红杀手”,其发病率位居女性恶性肿瘤的首位。HER2是EGFR家族的一种受体酪氨酸激酶(RTK),乳腺癌中大约有15-20%的HER2存在扩增。
之前研究表明,BECN1(苄氯素1重组蛋白,自噬过程中的一个关键蛋白,对于维持细胞内物质循环和能量平衡具有重要作用)和HER2在多个HER2过表达的乳腺癌细胞系和异种移植中相互作用,并且HER2过表达可以抑制自噬。此外,HER2突变体通过BECN1磷酸化抑制自噬,与其他酪氨酸激酶类似。而野生型HER2似乎不会磷酸化BECN1,而是以mTORC1依赖性方式抑制自噬。
因此,本研究想探寻可能介导HER2对BECN1和自噬影响的其他蛋白质。
二、研究思路方法与结论
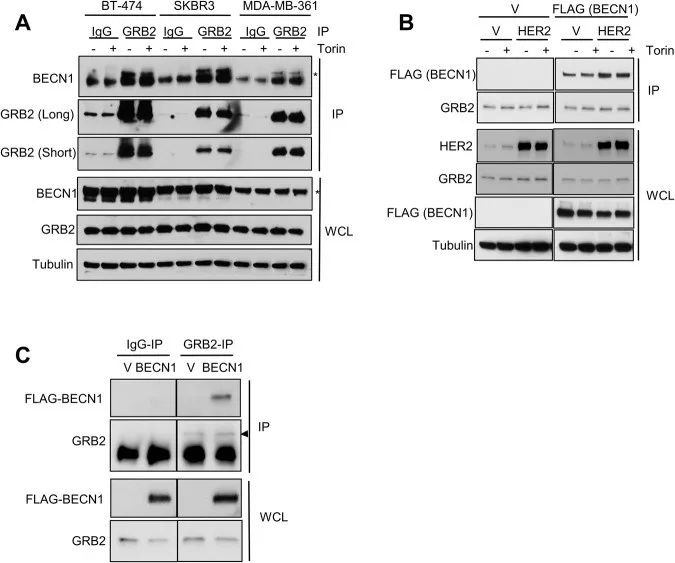
研究思路1:GRB2和BECN1是否在多种细胞系中均相互作用
研究方法:
(1)通过自噬研究相关网络数据库中搜索BECN1相互作用蛋白。
(2)对HER2高水平表达的三种乳腺癌细胞系(即SKBR3、BT474和MDA-MB-361)中的GRB2进行免疫共沉淀。
(3)雌激素和孕激素受体呈阳性且BECN1低水平表达的HER2阴性乳腺癌细胞(MCF7)中,被转导以稳定表达HER2和FLAG标记的BECN1,经过Torin1处理后,对内源性GRB2进行免疫沉淀,并通过蛋白质印迹进行分析。
(4)在过表达HER2的细胞以及空载体对照细胞的所有样本中,检测FLAG-BECN1与GRB2是否发生免疫共沉淀。
(5)对其他非乳腺癌细胞系中,例如HeLas(宫颈腺癌)进行相同实验分析。
研究结论:
GRB2和BECN1在多个细胞系中也独立于HER2和mTOR相互作用,表明这种结合可能是所有细胞中发生的普遍事件。
研究思路2:GRB2是否对自噬有影响,并进一步探究对自噬的调节机制
研究方法:
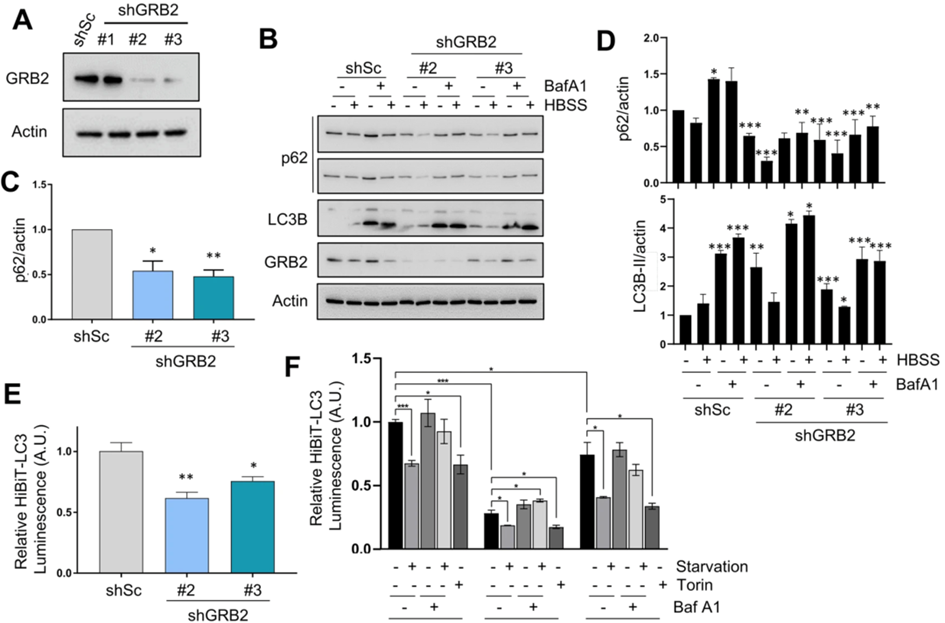
(1)在短发夹RNA(shRNA)的HeLa细胞中敲低GRB2,通过三种针对GRB2的不同的shRNA序列,分析蛋白质水平,探寻敲低效率最高的细胞。
(2)通过蛋白质印迹分析、HiBiT-LC3报告基因(检测HiBiT(荧光素酶亚基)标记的LC3蛋白的总水平)分析自噬通量,通过GFP-LC3报告基因定量自噬体形成,进一步分析自噬流。
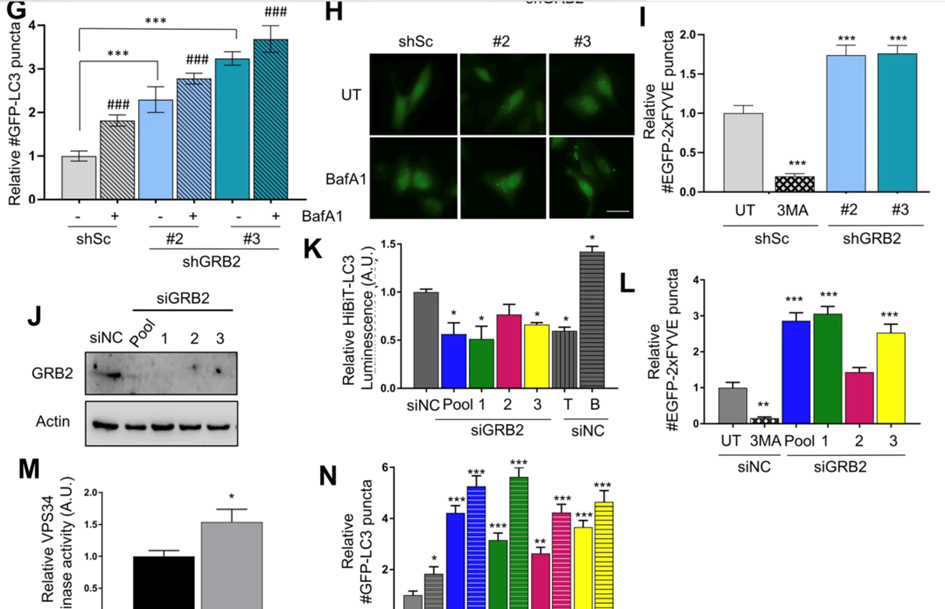
(3)通过EGFP-2xFYVE荧光报告基因间接测量VPS34催化活性,分析III类PI3激酶复合物1(PI3KC3-C1)的催化亚基VPS34的活性是否受到GRB2的调节。
(4)在HeLa细胞中重复实验,经过Torin处理或BafilomycinA1处理,进行HiBiT-LC3测定分析。
(5)对GRB2耗尽的样品进行脂质体外激酶测定和GFP-LC3自噬体形成测定,进一步证实对VPS34活性的影响。
(6)多种细胞系中重复实验(包括U2OS(源自骨肉瘤)、HER2过表达乳腺癌细胞系BT474和SKBR3)。
(7)在HER2过表达乳腺癌细胞系BT474和SKBR3中通过CRISPR-Cas9敲除、shRNA或siRNA敲除进行类似的实验,对两个不同的BT-474CRISPR-Cas9克隆进行分析。确定GFP-LC3斑点的数量以及VPS34活性。
(8)检测GRB2的自噬作用是否依赖于PI3K/AKT/mTOR或JNK/MAPK通路。分析耗尽GRB2的HeLa细胞在氨基酸饥饿和随后补充时调节mTORC1的能力。
研究结论:
(1)GBR2确实是自噬的调节因子。
(2)VPS34还在多种细胞系中与GRB2发生免疫共沉淀,GRB2敲低会诱导自噬,并调节U2OS细胞中的VPS34激酶活性。
(3)GRB2的缺失会独立于HER2诱导自噬,可能通过调节VPS34的活性来调节自噬。并且GRB2敲低不会影响MAPK通路和mTORC1活性。
研究思路3:深入探究BECN1和GRB2之间的相互作用机制
研究方法:
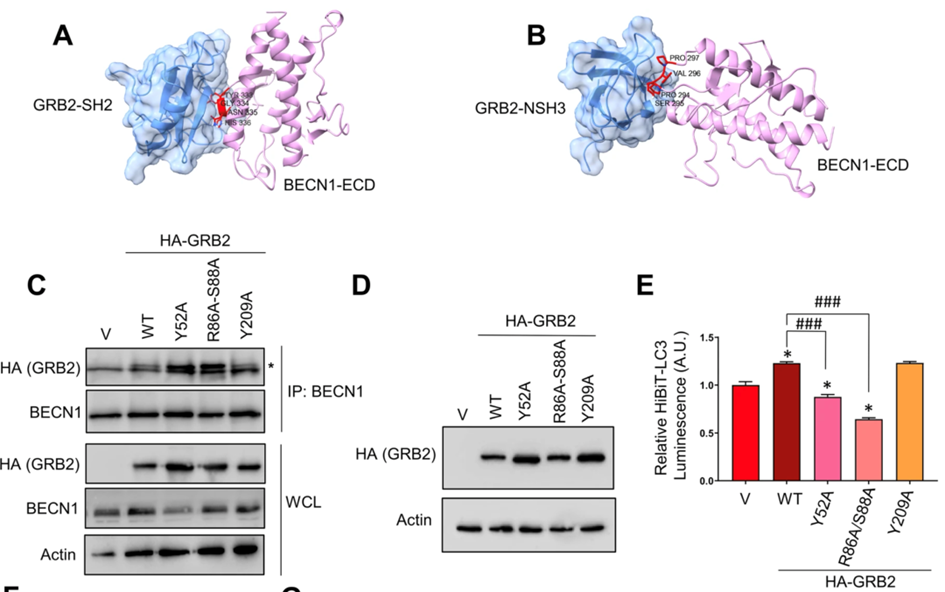
(1)鉴定GRB2中的残基,通过蛋白质-蛋白质对接确定GRB2是否可以与BECN1有不同相互作用形式。
(2)建立BECN1和GRB2潜在相互作用位点的计算机模型,在过表达FLAG-BECN1-WT或敲除ECD结构域突变体(dECD,d267-450)的HeLa细胞中进行的免疫共沉淀实验。
(3)生成稳定过表达GRB2-WT或相应的非功能突变体的HeLa细胞系,进行内源性BECN1的免疫共沉淀实验。
(4)分析这些突变对自噬的影响,并通过蛋白质印迹分析不同野生型和突变型GRB2蛋白的表达水平,利用HiBiT-LC3测定GRB2过度表达、含有突变残基Y52A和R86A-S88A的蛋白质对自噬的影响。
(5)用EGFP-2xFYVE报告基因转染HeLa细胞并测量PI3P的形成,确定这种自噬调节是否也通过调节VPS34催化活性来发生。
(6)通过GFP-LC3自噬体形成测定,确认Y52A和R86A-S88A等突变体的过表达对自噬的不同影响。
(7)针对GRB23'-UTR的siRNA寡核苷酸瞬时转染细胞,用寡核苷酸(siUTR)或针对GRB2读码框的寡聚体瞬时转染HeLa细胞(发光读数的减少(表明自噬通量增加)可以通过WT-GRB2的过表达来挽救),评估体外VPS34的活性。
(8)在接种后第0天和第3天对细胞进行铺板分析,确定过表达GRB2或所示突变体对细胞生长和增殖的影响。
研究结论:
(1)鉴定自噬调节中GRB2的必需残基,发现GRB2-WT的过表达抑制自噬,并且Y52、R86和S88残基对于GRB2调节自噬很重要。
(2)VPS34活性调节的机制是自噬的负性调节因子,GRB2Y52A和R86A-S88A是功能丧失的突变体,不能抑制自噬。
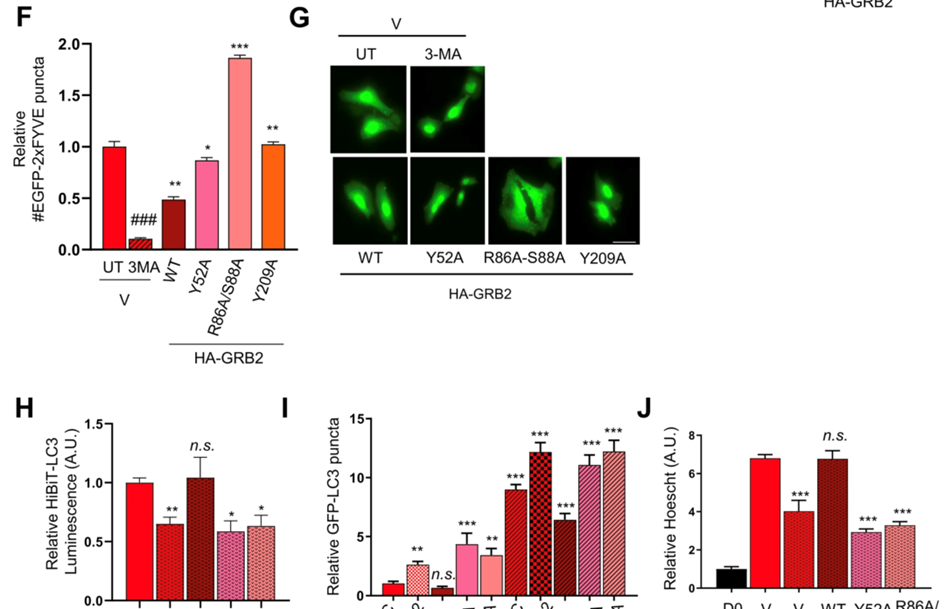
研究思路4:GRB2对肿瘤发生的影响
研究方法:
(1)将敲除GRB2或过表达GRB2-WT的HeLa细胞和相应的突变体分别植入到鸡胚尿囊膜(CAM)上,通过卵内模型进一步评估GRB2在肿瘤形成和肿瘤生长中的影响。
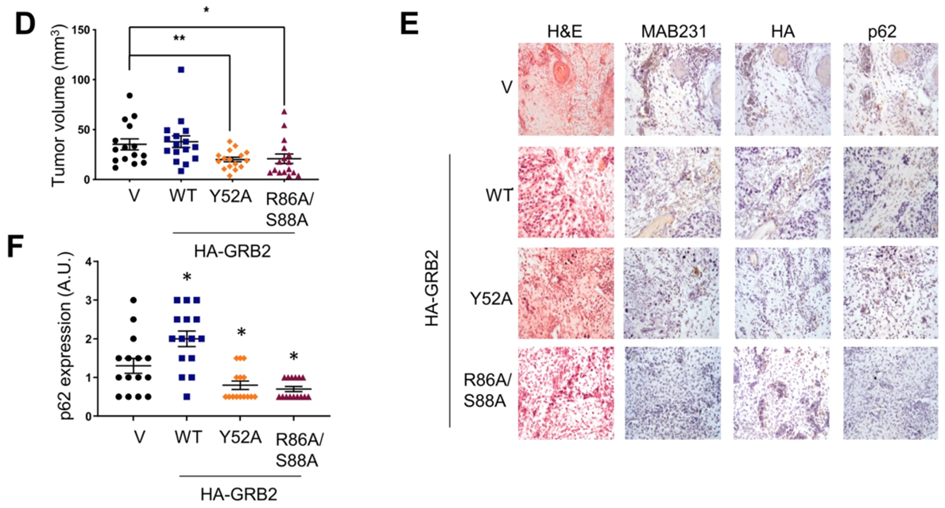
(2)评估GRB2敲低是否会影响至7天植入期结束。通过蛋白质印迹检测GRB2的表达水平,以确定GRB2蛋白的消耗量。组织学分析GRB2敲低后其p62水平。
(3)通过植入当天细胞的蛋白质印迹分析,肿瘤形状和形态分析、IHC分析和p62蛋白定量,探讨自噬功能丧失突变体的卵内效应。
研究结论:
GRB2 过表达可诱导 CAM 模型中的肿瘤发生。
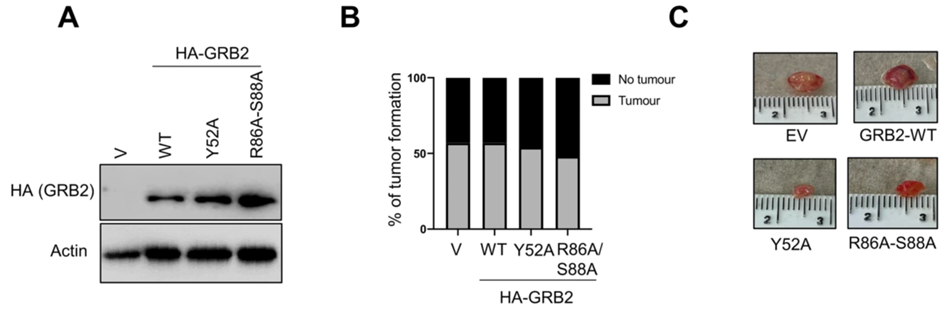
研究思路5:确定GRB2的潜在临床相关性
研究方法:
(1)分析了BRCA-TCGA和METABRIC数据库的基因表达数据。
(2)对前瞻性入组的801名早期乳腺癌患者的乳腺癌样本的蛋白质水平进行检测。
研究结论:
临床样本中 GRB2 的表达与 p62 水平相关,是一种新的BECN1相互作用蛋白,也是自噬和肿瘤生长的潜在新调节因子。
三、小结
GRB2是HER2(以及其他几种酪氨酸激酶)的接头蛋白,研究员们将其鉴定为新型BECN1相互作用伙伴。GRB2在多种乳腺癌细胞系中与BECN1免疫共沉淀,并通过涉及调节III类PI3激酶VPS34的活性机制来调节自噬。CAM模型的卵内研究表明,GRB2敲低或GRB2功能丧失突变体(Y52A和S86A-R88A)的过表达会抑制肿瘤生长,表明自噬可能与肿瘤发生相关,强调了GRB2作为BECN1结合蛋白和自噬调节因子的新功能。
参考来源:
Montero-Vergara J, Plachetta K, et al. GRB2 is a BECN1 interacting protein that regulates autophagy. Cell Death Dis. 2024 Jan 5;15(1):14.













